|
Quorum Sensing nennt man die Fähigkeit von Einzellern über chemische Kommunikation die Zelldichte der Population messen zu können.
| Ein wesentlicher Bestandteil Ihrer Anlage ist der Biofilter. Dieser entscheidet über den Erfolg Ihrer Anlage. In diesem Zusammenhang sind die Eigenschaften der Bakterien, die für die Reinigung, Umwandlung und Aufbereitung Ihrer Nährstoffe verwendet werden, von hoher Bedeutung. Dieser Artikel beleuchtet die Kommunikation der Bakterien untereinander. Wenn die Umgebungsbedingungen für Ihren Filter nicht optimal eingestellt sind kann es sein das dieser im schlimmsten Fall einfach gar nicht funktioniert oder im etwas günstigeren Fall nur mit einem Bruchteil seiner Kapazität arbeiten kann. Nach Aussagen von Fischerei-Experten des LANUV und des Ministeriums gehen die Erfahrungen aus der Praxis dahin, dass neue Anlagen in den ersten Jahren nur ca. 10% - 30% der maximal möglichen Biomasse produzieren. Im stabilen Betrieb werden Kreislaufanlagen bei ca. 70% - 80% ihrer Kapazität betrieben. |
Als Quorum Sensing (QS) wird die Fähigkeit von Einzellern bezeichnet, über chemische Kommunikation mittels hoch spezifischer Signalmoleküle die Zelldichte der Population der eigenen Art und die Komplexität der Gemeinschaft messen zu können. Auch der Kontakt der Bakterien mit höheren Lebewesen wird über QS reguliert. Bakterien können über QS schnell auf Veränderungen ihrer Umgebung reagieren, um das Überleben der Population zu sichern, Vorteile gegenüber Konkurrenten zu erlangen und um neue geeignete ökologische Nischen zu erschließen. Dabei können sie gezielt die Kommunikation anderer Bakterien stören. Das QS-System erlaubt den Mikroorganismen, sich geschützt in der Gemeinschaft, in Biofilmen, bis zu einer kritischen Zellzahl zu vermehren, um dann den Phänotyp der Population gemeinsam zu ändern. Dabei werden Gene nur dann aktiviert, wenn eine bestimmte Zelldichte, das Quorum, über- oder unterschritten wird.
|
|
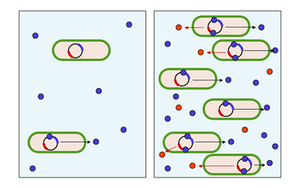
Schema des Quorum sensings,Links: Konzentration an Autoinduktormolekülen (blau) gering,Rechts: Konzentration an Autoinduktormolekülen hoch, dadurch Synthese des bakterielles Produkt (rot). Y_tambe • CC-BY-SA-3.0
|
An sich stammt der Begriff „Quorum“ aus der Zeit des römischen Reiches und bezeichnete im Senat die für eine Abstimmung benötigte geringste Zahl an Mitgliedern.
Quorum sensing wird von Bakterien genutzt, um Prozesse zu koordinieren, die ineffizient wären, wenn sie nur von einzelnen Zellen durchgeführt würden, z. B. Biolumineszenz, die Bildung von Biofilmen, die Sekretion von Antibiotika und Pathogenitätsfaktoren, die Fruchtkörperbildung bei Myxobakterien, die Sporulation bei Bacillus subtilis, die Infektion von Pflanzen[3] und anderen eukaryotischen Wirten[4] und die Beteiligung von Bakterien an Ökosystemen wie beispielsweise dem Korallenriff.[5] Durch QS wird das Verhalten der Bakterien einer Art auf engstem Raum koordiniert. Pseudomonas aeruginosa, ein Erreger von Lungenentzündung und anderen Infektionen, kann innerhalb seines Wirts leben, ohne ihn zu schädigen. Wenn er sich jedoch stark vermehrt, bilden die Zellen Biofilme, werden pathogen und können zur Erkrankung des Wirts führen.[6]
Die Bedeutung der Autoinduktoren im QS
Die Autoinduktoren sind allgemein frei diffundierende, amphiphile Moleküle, die über die Zellmembran von den Bakterien beständig in kleinen Mengen in die Umgebung abgegeben werden. Bei gramnegativen Bakterien sind dies vorwiegend niedermolekulare Verbindungen, während es sich bei grampositiven Bakterien um Oligopeptide handelt.[10] Über die Konzentration der abgegebenen Signalmoleküle können Bakterien die Populationsdichte und die Komplexität der Gemeinschaft messen und ab einer kritischen Konzentration den Phänotyp der Population verändern. Bakterien können in komplexen Milieus gleichzeitig über verschiedene QS-Systeme mit unterschiedlichen Autoinduktoren kommunizieren und sich im Kollektiv der jeweiligen Situation anpassen. Sie erhalten dadurch gegenüber anderen Bakterien einen Wettbewerbsvorteil.[11] So verwendet das marine Vibrio harveyi für die zwischenartliche Kommunikation und den Austausch zwischen den Gattungen drei unterschiedliche Autoinduktoren. Insgesamt können dabei bis zu 600 Gene reguliert werden.[12][13]
Die sezernierten Autoinduktoren lassen sich aufgrund ihrer chemischen Struktur und ihrer Rezeptoren verschiedenen Gruppen zuordnen:
Autoinduktor-1 (Al-1)
Autoinduktor-1 (Al-1) ist vor allem bei gramnegativen Bakterien vertreten und dient ausschließlich der innerartlichen Kommunikation. Die meisten Bakterien verwenden acylierte Homoserinlaktone, (N-Acyl-Homoserinlakton, (AHL)) als Signalmolekül, einige auch Aryl-Homoserinlakton für die interspezifische Kommunikation. Die Synthese geht von der Aminosäure S-Adenosylmethionin aus. Die Länge der Alkylkette des N-Acyl-Homoserinlaktons kann variieren, Modifikationen aufweisen und dadurch zusätzlich die Stabilität sowie die Signaldynamik des Moleküls beeinflussen.[14][15] Die N-Acyl-Homoserinlaktone werden mit Hilfe der bakteriellen Enzyme aus der Familie der LuxI-Synthase, (AHL-Synthase) produziert.[16] Die hydrophoben AHL-Moleküle sind membrangängig und reichern sich in der Umgebung der Bakterien an. Nach Erreichen der Schwellenkonzentration binden AHL an cytoplasmatische Rezeptorproteine der LuxR-Familie und induzieren durch Bindung an die DNA vielfältige biologische Prozesse.[17] Dieses LuxI/LuxR-QS-System mit AHL als Signalmolekül ist für viele gramnegative Bakterien typisch.
Es gibt verschiedene Varianten des Systems, beispielsweise bei Pseudomonas aeruginosa mit dem Autoinduktor N-Butyroyl-L-Homoserinlakton und dem RhlI/RhlR-QS-System und bei Chromobacterium violaceum mit N-Hexanoyl-L-Homoserinlakton und dem Cvil/CviR-QS-System.[18]
Viele Proteobakterien besitzen zusätzlich zu dem LuxI/LuxR-QS-System weitere LuxR- homologe Rezeptoren, dabei aber keine Synthasen, die der LuxI-Synthase verwandt sind. Diese Systeme bezeichnet man als LuxI-Solo. Sie ermöglichen Bakterien auf exogen produziertes AHL zu reagieren und damit eine Kommunikation mit anderen artfremden Bakterien einzugehen.[19]
Neben diesen gängigen AHL verwenden einige gramnegative pathogene Bakterien für die Kommunikation mit ihren Wirten andere Signalmoleküle, aber Rezeptoren, die mit dem LuxR-Typ homolog sind. Beispielsweise verwendet das insektenpathogene Photorhabdus luminescens 2-Pyrone oder Photopyrone als Signalmoleküle, die von der Pyronsynthase (Ppys) gebildet werden und an den LuxR-homologen Rezeptor PluR binden. Über dieses PpyS/PluR-QS-System steuert der Erreger die zur Virulenz gehörende Zellverklumpung.[20] Das insektenpathogene und humanpathogene Bakterium Photorhabdus asymbiotica besitzt ebenfalls keine LuxI-Synthase. Dieses Bakterium steuert die Kommunikation über Dialkylresorzinole und Cyclohexandione, die ebenfalls an LuxR-homologe PauR-Rezeptoren binden und damit die Virulenz über das DarA/DarB/DarC/PauR-QS-System regulieren.[21]
Autoinduktor-2 (Al-2)
Autoindutkor-2 (Al-2) kommt in gramnegativen und grampositiven Bakterien verschiedener Taxa vor und ist in die zwischenartliche Kommunikation involviert, aber nicht universell vertreten.[22] Chemisch handelt es sich um zyklische Furanosylboratdiester.[23] Ausgehend aus der Vorstufe, dem 4,5-Dihydroxy-2,3-Pentandion (DPD), gebildet durch das LuxS-Enzym, zerfällt DPD in wässriger Lösung in zwei Enantiomere, die sich in einem chemischen Gleichgewicht befinden. 4,5-Dihydorxy-2,3-Pentandion komplexiert mit Bor zum zyklischen Furanosylboratdiester und bildet das Signalmolekül Al-2.[24] Die Synthese von Al-2 scheint ebenfalls über positive Rückkoppelung reguliert zu werden.[25] Bei Vibrio cholerae bindet Al-2 an den periplasmatisch lokalisierten Rezeptor LuxP, der mit der Sensorkinase LuxQ interagiert, die je nach Status des QS-Systems als Kinase oder Phosphatase fungieren kann und damit beispielsweise die Expression der Gene zur Biofilmbildung an- oder ausschaltet.[26] Al-2 liefert Informationen über Stoffwechselaktivitäten der Bakterien in der Umgebung und über deren mikrobielle Besiedlung. In den Bakterienpopulationen von Escherichia coli und Salmonella typhimurium bewirken Milieubedingungen: bevorzugte Kohlenstoffquellen, niedriger pH-Wert und hohe Osmolarität, eine Induktion der Synthese von Al-2, während schlechte Bedingungen, stationäre Wachstumsphase der Bakterienpopulation, aufgebrauchte Kohlenstoffquellen, niedrige Osmolarität und ein veränderter pH-Wert, einen Abbau von Al-2 nach sich ziehen.[27]
Autoinduktor-3 (Al-3)
Autoinduktoren-3 (Al-3) kommen zusätzlich zu anderen Autoinduktoren in verschiedenen pathogenen gramnegativen Bakterien wie beispielsweise in enterohämorrhagischen Escherichia coli, (EHEC), Vibrionen und in grampositiven Erreger wie beispielsweise Staphylococcus aureus vor und werden unter Stressbedingungen induziert. Chemisch handelt es sich bei Vibrio cholerae um verschiedene Pyrazin-Metabolite, wie zum Beispiel 3,5-Dimethylpyrazin-2-ol (DPO), die aus der Aminosäure L-Threonin durch die Threonindehydrogenase gebildet werden. DPO bindet an den zytoplasmatischen LuxR-Rezeptor VqmA. Dieser Signal-Rezeptor-Komplex induziert die Transkription von VqmR einer sRNA, die mehrere mRNAs aus verschiedene QS-Systemen regulieren kann. Während VqmA einerseits die Transkriptionsfaktoren für die Biofilmbindung kontrolliert, können gleichzeitig die Transkriptionsfaktoren für die Gene der Virulenzfaktoren durch VqmA gehemmt werden.[28] Die Autoinduktoren 2,5-Dimethylpyrazin (DMP) und 3,5-disubstituierte Pyrazin-2-ol-Analogon werden aus der Vorstufe Aminoaceton synthetisiert.[29]
Autoinduktorpeptide
Die grampositiven Bakterien verwenden lineare oder zyklische Oligopeptide, Autoinduktorpeptide. Diese sehr heterogene Gruppe der Peptide werden als Präpropeptide synthetisiert und während des aktiven Transports aktiviert. Beispiele für diese Gruppe bilden das Peptidhormon oder autoinduzierendes Peptid (AIP) von Staphylococcus aureus sowie das kompetenzstimulierende Peptid (CSP) von Streptococcus mitis und Streptococcus pneumoniae.[30] Bei Staphylococcus aureus bindet das AIP an den QS-Rezeptor AgrC, einen Transmembranrezeptor mit einer Histidinkinase, die durch Phosphorylierung einen intrazellulären Transkriptionsfaktor aktiviert und damit die Genexpression induziert. Das Signal wird hier über ein Zweikomponentensystem in der Zelle weitergeben. Die vier Komponenten des QS-Systems sind genetisch in einem arg-Operon organisiert.[31]
Quellen:
- Kenneth H. Nealson, Terry Platt und J. Woodland Hastings: Cellular control of the synthesis and activity of the bacterial luminescent system. In: Journal of Bacteriology, Band 104, Nummer 1, S. 313-22, 1970, doi:10.1128/jb.104.1.313-322.1970, PMID 5473898, PMC 248216 (freier Volltext).
- ↑ W. C. Fuqua, S. C. Winans, E. P. Greenberg: Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators. In: Journal of bacteriology. Band 176, Nummer 2, Januar 1994, S. 269–275, PMID 8288518, PMC 205046 (freier Volltext), (Review).
- ↑ Kathrin Riedel, Susan Schönmann und Leo Eberl: Quorum sensing in Pflanzen-assoziierten Bakterien. In: BIOspektrum, Band 11, Jahrgang 4, S. 385–388, (freier Volltext).
- ↑ Bonnie L. Bassler und Richard Losick: Bacterially speaking. In: Cell (Zeitschrift), Band 125, 2 Jahrgang, S. 237–246, 21. April 2006, doi:10.1016/j.cell.2006.04.001, (freier Volltext).
- ↑ Laura R. Hmelo: Quorum Sensing in Marine Microbial Environments. In: Annual Review of Marine Science, Band 9, S. 257–281, 3. Januar 2017, doi:10.1146/annurev-marine-010816-060656.
- ↑ Roger S. Smith und Barbara H. Iglewski: Pseudomonas aeruginosa quorum sensing as a potential antimicrobial target. In: Journal of Clinical Investigation, Band 112, Nummer 10, S. 1460–1465, 15. November 2003, doi:10.1172/JCI20364, (freier Volltext).
- ↑ Franziska S. Birmes und Susanne Fetzner: Quorum sensing Bakterielle Kommunikation: Signale und Signal-inaktivierende Enzyme. In: BIOspektrum, 22. Jahrgang, 2016, doi:10.1007/s12268-016-0681-4, (freier Volltext).
- ↑ Michael J. Federle: Autoinducer-2-based chemical communication in bacteria: complexities of interspecies signaling. In: Contributions to Microbiology, Band 16, Nummer 18, 2009, PMID 19494577, doi:10.1159/000219371.
- ↑ H. Sztaljer, A. Lemme und I. Wagner-Döbler: Quorum Sensing und Karies. In: BIOspektrum, 14. Jahrgang, S. 578–582, 2008, (freier Volltext).
- ↑ Yannick Hecher und Kai Papernfort: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Ausgabe 2, S. 136–138, März 2020, doi:10.1007/s12268-020-1344-z.
- ↑ Yannick Hecher und Kai Papenport: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Nummer 2, S. 136–138, März 2020, doi:10.1007/s12268-020-1344-z.
- ↑ Melissa B Miller, Karen Skorupski, Derrick H Lenz, Ronald K Taylor und Bonnie L Bassler: Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae. In: Cell (Zeitschrift), Band 110, Ausgabe 3, S. 303-14, 9. August 2002, doi:10.1371/journal.ppat.1008313, (freier Volltext).
- ↑ Julia C van Kessel, Steven T Rutherford, Yi Shao, Alan F Utria und Bonnie L Bassler: Individual and combined roles of the master regulators AphA and LuxR in control of the Vibrio harveyi quorum-sensing regulon. In: Journal of Bacteriology, Band 195, Ausgabe 3, S. 436-43, Februar 2013, doi:10.1128/JB.01998-12, (freier Volltext).
- ↑ Kai Papenfort und Bonnie Bassler: Quorum-Sensing Signal-Response Systems in Gram-Negative Bacteria. In: Nature Reviews Microbiology, Band 14, Nummer 9, S. 576–588, 11. August 2016, doi:10.1038/nrmicro.2016.89, PMID 27510864.
- ↑ Warren R.J.D Galloway, James T. Hodgkinson, Steven D. Bowden, Martin Welch und David R. Spring: Quorum sensing in Gram-negative bacteria: small-molecule modulation of AHL and AI-2 quorum sensing pathways. In: Chemical Reviews, Band 111, Nummer 1, S. 28–67, 12. Januar 2011, doi:10.1021/cr100109t.
- ↑ Rebecca J Case, Maurizio Labbate und Staffan Kjelleberg: AHL-driven quorum-sensing circuits: their frequency and function among the Proteobacteria. In: ISME Journal, Band 2, Nummer 4, S. 345-9, April 2008, doi:10.1038/ismej.2008.13.
- ↑ Kai Papenfort und Bonnie Bassler: Quorum-Sensing Signal-Response Systems in Gram-Negative Bacteria. In: Nature Reviews Microbiology, Band 14, Nummer 9, S. 576–588, 11. August 2016, doi:10.1038/nrmicro.2016.89, PMID 27510864.
- ↑ Nazzareno Dominelli und Ralf Heermann: Die stille Kommunikation der Bakterien Small Talk. In: Biologie in unserer Zeit, Band 50, S. 414–423, 2020, doi:10.1002/biuz.202010720, (freier Volltext).
- ↑ Sophie Brameyer, Darko Kresovic, Helge B Bode und Ralf Heermann: Dialkylresorcinole als bakterielle Signalmoleküle. In: Proceedings of the National Academy of Sciences, Band 112, Nummer 2, S. 572-7, 2015, doi:10.1073/pnas.1417685112, (freier Volltext).
- ↑ Nazzareno Dominelli und Ralf Heermann: Die stille Kommunikation der Bakterien Small Talk. In: Biologie in unserer Zeit, Band 50, S. 414–423, 2020, doi:10.1002/biuz.202010720, (freier Volltext).
- ↑ Sophie Brameyer, Darko Kresovic, Helge B Bode und Ralf Heermann: Dialkylresorcinole als bakterielle Signalmoleküle. In: Proceedings of the National Academy of Sciences, Band 112, Nummer 2, S. 572-7, 2015, doi:10.1073/pnas.1417685112, (freier Volltext).
- ↑ Michael J. Federle: Autoinducer-2-based chemical communication in bacteria: complexities of interspecies signaling. In: Contributions to Microbiology, Band 16, S. 18–32, 2009, doi:10.1159/000219371, PMID 19494577.
- ↑ Michael J. Federle. Autoinducer-2-based chemical communication in bacteria: complexities of interspecies signaling. In: Contributions to Microbiology, Band 16, S. 18–32, 2. Juni 2009, doi:10.1159/000219371, PMID 19494577.
- ↑ Helena Sztajer, André Lemme und Irene Wagner-Döbler: Streptococcus mutans Quorum Sensing und Karies. In: BIOspektrum, 14. Jahrgang, 2008.
- ↑ Helena Sztajer, André Lemme, Ramiro Vilchez, Stefan Schulz, Robert Geffers, Cindy Ying Yin Yip, Celine M. Levesque, Dennis G. Cvitkovitch, und Irene Wagner-Döbler: Autoinducer-2-regulated genes in Streptococcus mutans UA159 and global metabolic effect of the luxS mutation. In: Journal of Bacteriology, Band 190, Nummer 1, S. 401–415, 2008, doi:10.1128/JB.01086-07, PMID 17981981, (freier Volltext).
- ↑ Yannick Hecher und Kai Papenfort: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Nummer 2, S. 136–138, 2020, doi:10.1007/s12268-020-1344-z.
- ↑ Michael G. Surette, Melissa B. Miller, und Bonnie L. Bassler: Quorum sensing in Escherichia coli, Salmonella typhimurium, and Vibrio harveyi: A new family of genes responsible for autoinducer production. In: Proceedings of the National Academy of Sciences, Band 96, Nummer 4, 16. Februar 1999 S. 1639–1644, doi:10.1073/pnas.96.4.1639, (freier Volltext).
- ↑ Yannick Hecher und Kai Papenfort: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Nummer 2, S. 136–138, 2020, doi:10.1007/s12268-020-1344-z.
- ↑ Chung Sub Kim, Alexandra Gatsios, Santiago Cuesta, Yick Chong Lam, Zheng Wei, Haiwei Chen, Regan M. Russell, Emilee E. Shine, Rurun Wang, Thomas P. Wyche, Grazia Piizzi, Richard A. Flavell, Noah W. Palm, Vanessa Sperandio und Jason M. Crawford: Characterization of Autoinducer-3 Structure and Biosynthesis in E. coli. In: ACS Central Science, Band 6, Nummer 2, S. 197–206, 22. Januar 2020, doi:10.1021/acscentsci.9b01076, PMID 32123737, PMC 7047286 (freier Volltext).
- ↑ Frederick Verbeke, Severine De Craemer, Nathan Debunne, Yorick Janssens, Evelien Wynendaele, Christophe Van de Wiele und Bart De Spiegeleer: Peptides as Quorum Sensing Molecules: Measurement Techniques and Obtained Levels In vitro and In vivo. In: Frontiers in Neuroscience, Band 11, S. 183, 12. April 2017, doi:10.3389/fnins.2017.00183, (freier Volltext).
- ↑ Joseph K. Vasquez und Helen E. Blackwell: Simplified Autoinducing Peptide Mimetics with Single-Nanomolar Activity Against the Staphylococcus aureus AgrC Quorum Sensing Receptor. In: ACS Infectious Diseases, Band 5, Nummer 4, S. 484–492, 2019, doi:10.1021/acsinfecdis.9b00002, (freier Volltext).
- https://de.m.wikipedia.org/wiki/Quorum_sensing
Bild: Schema des Quorum sensings,Links: Konzentration an Autoinduktormolekülen (blau) gering,Rechts: Konzentration an Autoinduktormolekülen hoch, dadurch Synthese des bakterielles Produkt (rot). Y_tambe • CC-BY-SA-3.0
Kontext:
ID: 295
|



Kommentar hinzufügen